
中枢概日時計・視交叉上核神経ネットワークの動作原理を明らかにすること、さらに中枢概日時計が脳機能や全身のホメオスタシス・ホメオダイナミクスを制御するメカニズムを統合的に理解することを目指しています。また、中枢概日時計の異常により生ずる疾患病態の研究や疾患モデルの開発にも発展させていきたいと考えています。
地球上のほとんどの生物で、様々な生命活動が約24時間周期で変動するリズム(概日リズム、サーカディアンリズム)を刻んでいます。ヒトを含む哺乳動物では、睡眠や行動、多くの身体機能(ホルモン分泌、自律神経機能、等々)に概日リズムが存在します。脳内の視床下部の一部、視交叉上核(SCN: suprachiasmatic nucleus)に存在する体内時計(中枢概日時計)により概日リズムは制御されており、例えば1日のどの時間帯で起きて活動するか、大まかなパターンが決められます。概日リズムは地球の自転に伴う昼夜の環境変化を予測して内部環境や行動を最適化するシステムです。一方で、体内時計の刻む時刻と外界の時刻がずれると、さまざまな問題が生じます。海外旅行で時差ボケになるのは、体内時計が現地時間にすぐには馴染めないためと考えられます。また、夜間勤務などによる概日リズムの乱れは睡眠障害のみならず、気分障害、癌やメタボリックシンドロームなど、様々な健康障害・疾患のリスクを高めると報告されています。したがって、体内時計のメカニズムを理解し、体内時計を制御する方法(例えば薬剤)を開発することは、生活リズムが乱れがちな現代社会においては、大きな意義を持つと思われます。
視交叉上核は約2万個の神経細胞でできています。この神経細胞群は均一な集団ではなく、性質の異なる複数のタイプの神経細胞から成り立っています。各神経細胞は自分自身で概日リズムを刻む能力をある程度は持ちますが、視交叉上核が中枢概日時計として強固で安定した概日リズムを発振するためには、神経細胞間でネットワークを形成して互いにコミュニケーションを取り合うことが必要です。これまでに、各細胞内で概日リズムを刻む遺伝子・分子メカニズム(細胞時計)についてはかなり明らかになりましたが、中枢概日時計の本質である神経ネットワークの動作メカニズムについては、まだよく分かっていません。
私たちは、視交叉上核神経ネットワークの中で、特定の種類の神経細胞に特異的に遺伝子操作や神経活動操作を加え、概日リズムの異常を詳細に解析するアプローチを採っています。例えば、バソプレシン産生神経細胞のみで細胞時計を破壊したマウスや、バソプレシン産生神経細胞の細胞時計の周期を操作したマウスを作成して解析することで、バソプレシン産生神経細胞が概日リズムの発振や周期決定に極めて重要な役割を果たしていることを見つけました(Mieda et al, Neuron 2015; Mieda et al, Curr Biol 2016)。このような種々の遺伝子操作マウスに、電気生理学、薬理学、神経解剖学、行動学、光遺伝学、化学遺伝学、分子生物学などの手法を適用し,中枢概日時計の動作原理を理解することを目指しています。
概日時計の周期が24時間から大きく外れると、外界の昼夜サイクル(24時間周期)に合わせることが難しくなります。実際、俗に言う宵っ張りの朝寝坊(夜型傾向)は中枢概日時計の周期が長いことが一因と考えられています。一方、時差ボケでは中枢概日時計の時刻が外界の時刻とずれています(位相がずれている)。歳をとると眠りが浅くなるのは、中枢概日時計の刻みが弱い(振幅が小さい)ためと考えられています。周期、位相、振幅、それぞれがどのように制御されているのか、中枢概日時計のメカニズムを正確に理解することで、概日時計の乱れに起因するさまざまな健康障害・疾患に対し、最も適切な改善・治療法を見出すことができるようになると期待されます。
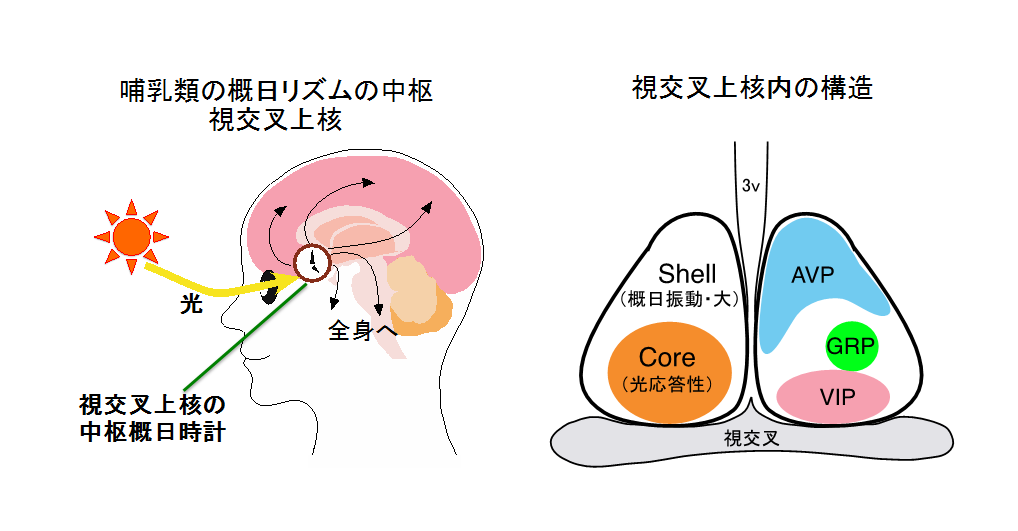
左:視交叉上核の発振する時刻情報は全身に送られ,さまざまな身体機能を調節します。中枢概日時計が持つ周期(“約”24時間)と地球の自転周期(24時間)とのずれは、周囲の光の情報が網膜を通して視交叉上核に伝えられて,中枢概日時計が毎日リセットされることで,解消されます。
右:視交叉上核は大きくcore(中核)とshell(外殻)に分けられます。光の情報を直接受容するのはcoreにある神経細胞です。Shellにはバソプレシン(AVP)産生神経細胞が、coreには血管作動性腸ペプチド(VIP)産生神経細胞やガストリン放出ペプチド(GRP)産生神経細胞が多く存在します。
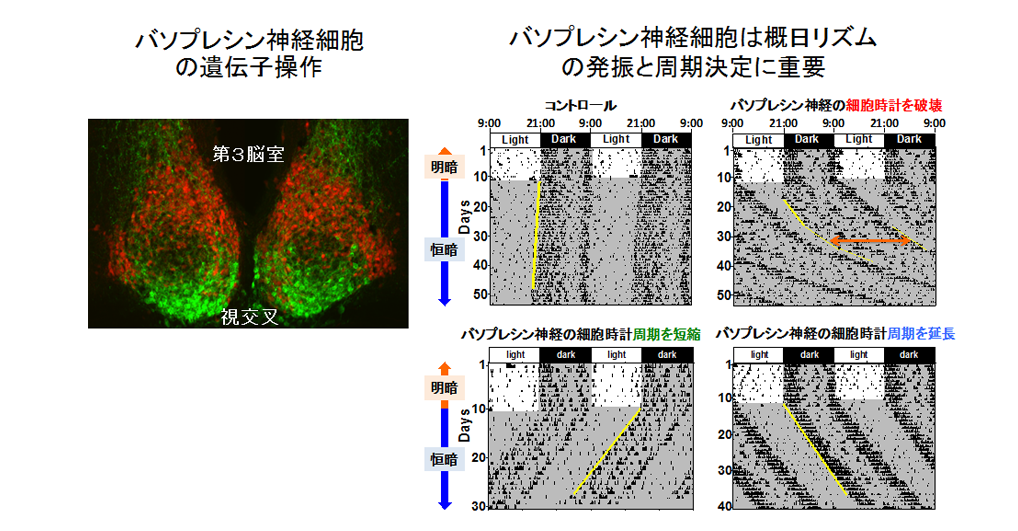
左:バソプレシン(AVP)産生神経細胞を特異的に操作するためのBACトランスジェニックマウスを作成しました。ここではバソプレシン神経細胞に赤色蛍光タンパク質を発現させています。血管作動性腸ペプチド(VIP)を抗体染色で緑色に標識してあります。
右:バソプレシン神経細胞特異的に細胞時計を操作したマウスの概日行動リズム。細かい縦線はその時刻に動いたことを表します。マウスは夜行性なので,夜に主に活動します。中枢概日時計の働きで,恒暗環境(一日中消灯)でもマウスは明瞭な行動の概日リズムを示します。黄色の線が垂直なら概日リズム周期は24時間。バソプレシン神経細胞だけで細胞時計を破壊すると、概日リズムが徐々に減衰して不明瞭になり、周期も長くなります(Mieda et al, 2015)。中には、概日リズムが消失するマウスもいます。一方、バソプレシン神経細胞が持つ細胞時計の周期を長くすると行動リズムの周期も長くなり、逆に短くすると行動リズムの周期も短くなります。つまり、バソプレシン神経細胞が中枢概日時計の周期を決めるペースメーカー細胞として働くことが分かります(Mieda et al, 2016)。
中枢概日時計により発振される概日リズムは数多くの生体機能を調節しますが、具体的にどのような経路やメカニズムで制御されるか明らかになっているものは、ほとんどありません。睡眠でさえ、中枢概日時計からどのような経路によって実際に調節されるのか、意外なほど分かっていません。
一方、中枢概日時計を調節する因子(同調因子)としては、外界の光が主要なものです。中枢概日時計の内因性の周期は24時間から少しずれているので、24時間周期の昼夜サイクルにあわせるため、外界の光が網膜視床下部路で視交叉上核に直接伝えられ、中枢概日時計の位相を毎日微調整します。しかし光の他に、はっきりと生理的意義が分かっている中枢概日時計の調節機構は知られていません。
私たちは、光遺伝学や化学遺伝学によるニューロンタイプ特異的な神経活動の人為的操作、組換えウィルスベクターを用いた神経回路トレーシング、遺伝子発現プロファイリングなどの手法を用い、中枢概日時計がさまざまな脳機能や末梢臓器機能を調節するメカニズム、中枢概日時計によって調節される新たな脳機能、また中枢概日時計を調節する新たなメカニズムを明らかにすることを目指しています。
これまで主に、神経ペプチド・オレキシンによる睡眠・覚醒調節機構に関して研究してきました(Mieda et al, J Neurosci 2011; Hasegawa et al, JCI 2014; Hasegawa et al, PNAS 2017、他)。また、覚醒システムの重要な要素であるヒスタミン神経細胞に入力する上流神経細胞を網羅的に同定しました。現在は同定した上流神経細胞によるヒスタミン産生神経細胞の調節機構について解析を行っています。また、睡眠・覚醒調節神経ネットワークと中枢概日時計との相互作用にも着目して、研究を進めています。
ヒスタミン産生神経細胞は視床下部の結節乳頭体核を中心に凝集しており、この領域から軸索を脳の広い範囲に伸ばし、様々な脳領域にヒスタミンを放出します。抗ヒスタミン薬が眠気を誘うことがよく知られているように、中枢ヒスタミン神経系は脳を覚醒させる働きをしますが、ほかにも概日周期、体温調節、エネルギー代謝などの恒常性維持機能や、記憶・学習、認知などの高次脳機能にも関与します。これまでそれらの脳機能についてヒスタミン神経系の果たす役割が精力的に研究され、新しい薬の開発に生かされています。しかしながら、未だ不明な点も多く残されており、ヒスタミン神経系が関わる異なる脳・生理機能が統合的に調節される仕組みについての理解が不十分です。この問に対して、私たちはまずヒスタミン神経系にどのような情報が入力されるのかを明らかにしたいと考え、近年開発が進められた遺伝子改変型狂犬病ウイルスによる逆行性トランスシナプス標識法を用いて、ヒスタミン産生神経細胞にシナプス結合して入力情報を送る神経細胞群を網羅的に同定しました。現在はこの結果をもとに、その入力神経細胞の機能解析やヒスタミン産生神経細胞の神経活動を調節する仕組みについて解析をおこなっています。今後、睡眠・覚醒調節及び概日時計を制御する神経ネットワークとの相互作用にも着目して、研究を進めていきます。